含硫废水处理工艺实验研究
1含硫废水处理工艺的确定
1.1废水水量水质情况
天津渤天化工责任有限公司无机盐厂主要生产氯化钡、硫氢化钠和硫化钠等产品,三个车间年排放废水27万t,主要水量来自硫化钠车间的洗水和设备泄露等。废水主要含无机盐类物质,基本不含有机物,其中硫化物含量160~450mg/L,pH值8~9,水温15~45℃。公司要求处理后将废水的含硫量降低到10mg/L,然后进入生化处理系统。
1.2废水处理工艺的确定
目前,国内外处理含硫废水的方法很多,如碱吸收法、沉淀法、气提法、生化法、氧化法等。废水中硫化物的质量浓度为2000mg/L以上时,一般采用碱吸收法、沉淀法或气提法处理,且能回收其中的硫化物。废水中硫化物的质量浓度为50mg/L以下时,一般采用生化法处理,处理后的废水能达到排放标准要求。废水中硫化物的质量浓度为50~200mg/L时,国外趋向于采用湿式氧化法处理,其产物主要为硫酸盐,但该法能耗大,对设备材质要求苛刻,国内企业特别是中小企业,不宜采用。根据业主对出
水水质要求及废水水质情况,我们确定催化氧化法处理工艺。
2催化氧化法处理含硫废水的实验研究
2.1试验装置、试剂、分析方法
试验装置见图1。该装置采用空气为气源,用空气压缩机加压后,通过转子流量计控制气体流量,曝气头采用砂芯曝气头,向1L烧杯中水样充氧,形成气液接触,对水样中S2-进行催化氧化,同时用恒温水浴控制反应温度,用秒表计时。
 |
试验用试剂为硫酸锰、硫酸铜、硫酸亚铁、氯化钴、氢氧化钠、硫化氨、乙酸锌、乙酸钠、磷酸、硫代硫酸钠、硫化钠、碘、淀粉,均为分析纯,还有去离子水。
分析方法:测定硫化物的方法通常有对氨基二甲基苯胺光度法和碘量法。当水样中硫化物含量小于1mg/L时,采用对氨基二甲基苯胺光度法,样品中硫化物含量大于1mg/L时,采用碘量法。因此,本实验硫化物用碘量法进行测定。原理为硫化物与乙酸锌生成白色沉淀。将其溶于酸中,加入过量碘液,碘在酸性条件下和硫化物作用析出硫。然后用硫代硫酸钠滴定剩余的碘,计算硫化物含量。
pH值测定采用玻璃电极法。pH值可间接地表示水的酸碱程度,是水化学中常用的和最重要的检验项目之一。由于pH值受水温影响而变化,测定时应在规定的温度下进行,或者校正温度。通常采用玻璃电极法测定pH值。比色法简便,但受色度、浊度、胶体物质、氧化剂、还原剂及盐度的干扰。玻璃电极法不受以上因素的干扰,然而,pH值在10以上时,产生"钠差",读数偏低,需选用特制的"低钠差"玻璃电极,或使用与水样pH值相近的标准缓冲溶液对仪器进行校正。
2.2试验方法
试验采用(NH4)2S配制模拟水样(水样中S2-浓度为500mg/L),改变催化剂品种、催化剂用量、反应时间、反应温度、曝气量、反应液pH值等反应条件,记录模拟水样中S2-的去除率与这些条件改变的关系,通过分析得出最佳操作条件后,采用渤天无机盐分厂水样进行验证。
2.3试验结果
2.3.1曝气头充氧系数的测定
曝气充氧过程属于传质过程,氧的总传质系数在曝气充氧过程中代表了氧的总传递性。气膜中存在氧的分压梯度,在液膜中存在氧的浓度梯度,这就是氧转移的推动力。对于难溶解的氧来说,转移的决定性阻力主要集中在液膜上。液膜内氧转移的微分方程式为:
 |
实验原理:采用间歇非稳态法进行充氧性能测定,即实验时水不进不出,测定溶解氧浓度随时间变化。实验时向烧杯注满所需水后,先用脱氧剂无水亚硫酸钠和催化剂氯化钴进行脱氧,然后在溶解浓度等于零的状态下曝气。在充氧过程中,水中溶解氧的浓度C是曝气时间t的函数,测定水中溶解氧浓度是每隔15s记录下溶解氧仪显示的浓度值。
 |
测得,水深1m的情况下,砂芯曝气头的氧利用率为5%;折算成实际装置水深150mm时,氧利用率为3%。
2.3.2催化剂的选择
在常温、常压、无催化剂时,仅用空气氧化废水中的硫化物,需要很长的反应时间,但在某些催化剂的作用下可生成原子氧,使硫化物的氧化速度加快。醌类化合物和锰、铜、铁、钴、镍等金属的盐类以及活性炭、过氧化物均具有催化作用。在试验选择了MnSO4、CuSO4、FeSO4、CoCl2四种金属盐催化剂进行筛选,试验条件为室温下,反应时间为2h,催化剂用量为MnSO41.4g/L、CuSO41.4g/L、FeSO41.41g/L、CoCl21.21g/L。试验用水S2-浓度为500mg/L,pH为12,曝气量100L/h。实验结果见表1。
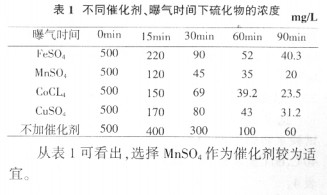 |
催化剂用量的选择
选定MnSO4用量为0.28g/L、0.84g/L、1.4g/L,pH值在12,曝气量为120L/h,试验水初始S2-浓度为500mg/L情况下,试验结果见表2。
 |
2.3.4曝气量的影响
理论上,每氧化1kgS2-成为SO42-需2kg氧,相当于6.7m3空气。1kgS2-成为S2O32-需要1kg氧,相当于3.3m3空气。1kgS2-成为S需0.5kg氧,相当于1.7m3空气。
结合砂芯曝气头效率,以及S2-氧化理论所需氧量,采用介于将S2-氧化成S2O32-、SO42-所需氧量安排试验。本试验分别选取曝气量60L/h、90L/h、120L/h,温度为室温,催化剂投量1.4g/L,试验水初始S2-浓度为500mg/L情况下,试验结果见表3。
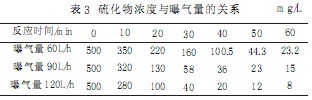 |
2.3.5pH值的影响
pH值对该反应有重要的影响,据资料报道,pH值愈小,废水中的硫化物以H2S的形式释出愈多,pH≤5时,废水中的硫化物以H2S的形式可全部被吹脱出来;pH≥8.5时,被吹脱出的H2S仅占4%(摩尔分数)。在酸性溶液中,硫化物被氧化时各电对具有较弱的氧化能力:
 |
由此可见,硫化物的氧化以碱性条件较为适宜。
据资料显示,pH值为10.5~13时,硫化物的氧化反应速度增长较快,pH值为11.5时,硫化物的氧化反应速度出现最大值,因此本研究中取pH值为12.0。
2.3.6温度的影响
选定MnSO4用量为1.4g/L、曝气量为120L/h,试验水初始浓度为500mg/L,在温度15℃、25℃、40℃、60℃测定S2-随时间的变化情况。试验结果见表4。
 |
从试验结果可以看出,温度在15~40℃范围内,硫化物的去除率变化不大。根据阿仑尼乌斯公式:反应温度常数与温度成指数关系,温度升高使速率常数变化,促进反应加速进行,又依据氧传递速率公式,温度升高使氧总传递速率变大,有利于提高氧的传递速率,加快硫化物的氧化速度,另一方面随温度的升高水中的溶解氧下降,降低了氧扩散动力,综合考虑这些因素,在本次试验中温度在15~40℃范围内进行催化氧化较为适宜。
2.3.7催化剂复用
选定MnSO4用量为1.4g/L,曝气量为120L/h,试验用水初始浓度为500mg/L,在室温下,重复进行催化氧化试验,每试验完毕后,用漏斗将催化剂过滤,再用试验用水洗入试验装置中,试验结果见表5。
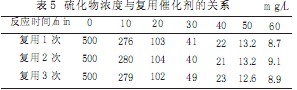 |
从试验结果可以看出,催化剂重复使用情况下,对硫的去除率影响不大,因此催化剂可重复使用。
2.3.8催化剂沉降试验
催化剂回收采用沉淀池,催化剂沉降试验的目的是测得颗粒沉淀速度u0,为工程设计提供依据。分散性固体颗粒的沉降称为自由沉淀。在其沉淀过程中,颗粒间互不凝聚,各自等速下沉,下沉过程中颗粒的物理性质不发生变化。在水深1.5m,直径200mm的沉淀柱内,通过不同的沉淀时间测定不同的沉淀速度,通过确定的沉淀时间t0可以求得沉淀速度u0。
按MnSO41.4g/L投加量,用5%NaOH调节pH值为12,曝气30min,形成含有棕黑色絮状沉淀的悬浮液,在沉降柱内沉降试验,测定催化剂的沉降速度。试验结果见表6。
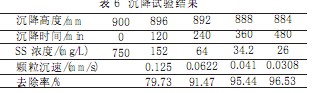 |
允许5%的催化剂的损失,因此选在去除率在95%时颗粒沉速为工程设计依据,即u0=0.05mm/s。
2.4模拟水样实验小结
通过对配制的模拟水样的试验研究得出如下
结论:催化剂选用MnSO4,投加量为1.4g/L,pH值为12,曝气量采用介于将硫离子氧化成硫代硫酸盐和硫酸盐所需的理论空气量,在室温条件下催化氧化1h,出水可以达到≤10mg/L的要求。
3渤天无机盐分厂水样验证试验
根据实验得出的结论,催化剂MnSO41.4g/L,pH值为12,曝气量120L/h,催化氧化时间1h,室温下对无机盐分厂的三组水样进行验证,出水S2

使用微信“扫一扫”功能添加“谷腾环保网”








