低溶氧下硝化生物膜中菌群的竞争增殖模型
在生物硝化过程中,氨首先由氨氧化菌氧化为亚硝酸盐,然后由亚硝酸氧化菌氧化为硝酸盐,整个硝化反应是两种菌群协同作用的结果。因此,菌群之间的生长和基质转化平衡至关重要,否则将造成中间产物亚硝酸盐的积累。另一方面,通过对硝化反应的两大菌群进行合理的调控,使硝化过程产生持久稳定的亚硝酸盐积累并直接进行反硝化,形成短程硝化—反硝化,则可以达到[1、2]:①在好氧阶段可减少25%的需氧量;②在缺氧阶段可减少40%的有机碳源;③亚硝酸盐的反硝化速率通常比硝酸盐高1.5~2.0倍[3]。这对大量的高氨氮低碳源废水处理具有十分重要的意义。实现亚硝酸盐积累的方法有游离氨抑制、纯种培养、温度选择等,但它们都只适用于一定的范围。通过控制反应体系中溶解氧浓度可在生物膜反应器中实现持久稳定的亚硝酸化,其原因是在硝化生物膜中存在着氨氧化菌和亚硝酸氧化菌之间对溶解氧的竞争利用,由此造成生物膜中菌群之间的竞争生长。两种菌群在硝化生物膜中的空间竞争特点,对反应器的设计以及工程操作都有很重要的意义。
本文目的是在低溶解氧条件下,建立生物流化床内硝化生物膜中两种菌群的竞争增殖模型,用以解释硝化反应生物膜中氨氧化菌和亚硝酸氧化菌之间的空间分布和对基质的竞争利用。
现有的生物膜模型大多为稳态模型[4],认为生物膜的性质(如生物膜的厚度、活性)、基质和微生物种群在生物膜中的分布都是恒定的。这些模型及所得结论极大地丰富了生物膜理论,但实际上即使反应器处在稳态条件下,生物膜的组成、厚度及种群分布也在不断变化。据此,Wanner等人建立了非稳态生物膜模型[5~7],它可以预测生物膜厚度的变化和描述微生物种群及基质在生物膜中的分布,目前被广泛采用,但是Wanner模型有以下几方面的缺陷:①Wanner模型是平板模型,即认为支持介质可以看作一个平板,而在生物流化床内采用微粒作为支持介质,其尺度与生物膜为同一数量级,这容易造成很大的误差;②Wanner模型认为整个生物膜都具有活性,但是随着微型传感技术的发展,证明在生物膜中O2的扩散深度通常为100μm左右。因此,好氧生物膜中具有活性的部分也为相同的数量级;③Wanner模型结构复杂,因素过多,计算过程繁琐,需要专门的软件计算求解,很难实际应用。
1表面活性膜扩张模型的建立
1.1基本思路
在生物膜体系中,基质、电子受体O2通过生物膜表面的液膜边界层向生物膜内部扩散传递。由于扩散阻力和生物反应造成基质浓度随生物膜深度变化而变化,与此相应生物膜中微生物菌群随深度呈非均相分布。
当生物膜增加到一定厚度时,在某一深度处,电子受体的浓度为零。以此为界,外层的微生物可同时得到基质和电子受体,进行正常的生物化学反应,为活性层;内层的微生物则由于得不到电子受体,其好氧生物化学反应将终止,为非活性层(见图1)。
|
|
一般来说,活性生物层就是距生物膜—水界面100μm左右的一层微生物。生物膜的增长实际上是活性层随时间在垂直于生物膜—水界面方向上向外扩张,非活性层逐渐变厚的过程。在活性层中,由于不同菌群对基质的亲和力不同以及增殖速率的差异,使生物膜中的组分在该层的扩张过程中不断变化。本模型的主要目的就是描述在硝化生物膜扩张过程中微生物组分的变化规律。
在生物膜反应器中,当溶解氧浓度在2mg/L以下时,硝化反应的速率受溶解氧水平限制。依此,根据质量守恒原理,首先建立活性层中溶解氧的扩散—反应方程,求解出生物膜中溶解氧的分布,然后根据溶解氧分布规律,通过生物膜的生长方程推导出微生物组分以及生物膜的扩张随时间的变化情况。
1.2基本假定
在模型的推导过程中假定:
①微生物颗粒为球形,生物膜在同一半径的球面上均匀分布。
②忽略外部传质,即不考虑液膜传质阻力。
③基质在膜内传质为分子扩散,忽略紊流等其他形式传质。
④生物膜的空隙率、密度以及氧的扩散系数[8]等不随深度发生变化。
⑤在微生物的增殖过程中不考虑细胞的内源代谢,微生物对基质的利用符合Monod模式。
⑥不考虑微生物膜由于受到流体剪切和生物颗粒之间的磨擦而发生的脱落。
⑦生物膜中由于硝化反应只发生在距离生物膜表面很近的薄层中[8、9],一般认为该层厚度约50~100μm,甚至有的认为仅在15~20μm内硝化微生物的活性较强[10]。因此假定在距离生物膜—水界面δ距离内的生物膜有活性。
⑧在假定⑦中的δ薄层中,生物膜的结构、微生物的成分等保持不变,即活性生物膜的成分只是时间的函数。
⑨温度保持不变,即各种动力学参数为常数。
1.3溶解氧扩散—反应模型的建立
由于基质扩散所需要的反应时间比微生物生长的特征时间要小好几个数量级,故相对于微生物增殖来说基质在生物膜中的分布可认为处于稳定状态。另外,理论和实验均已证明,当氧氨比<3.4时,溶解氧将成为反应的限制性因素[11]。因此,当液相中溶解氧的浓度<2.5mg/L时,氧就是硝化反应的限制基质[1]。所以,在生物膜中溶解氧的扩散—反应方程为:
|
|
式中Deff——基质在生物膜中的有效扩散系数,m2/s
Ci———基质i的浓度,mg/L
r———生物颗粒半径,mm
ri——基质i的消耗速率,mg/(mgVSS.d)
氧的比消耗速率可以认为是溶解氧浓度的一级反应,即:
|
|
式中qmax,NH4+,O2——氨氧化反应中氧的最大比反应速率,mgO2/(mgVSS.d)
qmax,NH2-,O2——亚硝酸氧化反应中氧的最大比反应速率,mgO2/(mgVSS.d)
Ko2,1——————氨氮化反应中氧气的半饱和常数
Ko2,2——————亚硝酸氧化反应中氧气的半饱和常
pj———————生物膜中第j种微生物的体积质量
fj———————生物膜中微生物菌群j所占的体积分率,对于硝化生物膜下标1指氨氮化菌,下标2指亚硝酸氧化菌
ε———————生物膜的空隙率
式中p、fj都只是时间的函数,与在薄层中的位置无关。根据假定⑨qmax,NO4+,O2、qmax,NO2-,O2、Ko2,1和Ko2,2均为常数。因此,式(2)可改为:
r02=KCO2(3)
式(3)中:
|
|
式(1)可以写为:
|
|
L——微生物膜——水界面处的半径,mm
h——生物膜中微生物的种类数
δ——活性层厚度,mm
CO
2,p——液相主体溶解氧浓度,mg/L
1.4生物膜增殖扩张模型的建立
考虑在t时刻活性生物层中第j种微生物的体积分率为fj,生物颗粒的半径为L,而在t+dt时刻,活性生物层中第j种微生物的体积分率为fj+df,生物颗粒的半径变为L+dL。在dt时间内活性生物层中第j种微生物的净增殖为:
 |
下面根据质量守恒建立生物膜扩张方程:在dt时间内活性生物第j种微生物的质量变化=在dt时间内活性生物层中第j种微生物的净增殖:
|
|
式中Yj,o2——生物膜中第j种微生物以氧气表示的细胞产率,mgVSS/mgO2
式(6)即为生物膜扩张方程,将其简化得:
|
|
式中uL——表面生物膜扩张速率,m/s可以表示为:
|
|
同时,生物腊怀液相界面处的半径L可以表示为:
|
|
式中ro——在时间为零时生物颗粒的半径,mm
对于硝化生物膜,考虑其生物种群仅为氨氧化菌和亚硝氧化菌两种,如果某一时刻氨氮化菌在微生物膜中所占的体积分率f1=f,则亚硝酸氧化菌在微生物膜中所占的体积分率f2=(1-f),将式(7)、(8)(9)联立可以写成以下形式:
|
|
联立式(5)、(10)、(11),根据f和L初始值以及相应的参数值(表1),可以求出生物膜中不同种类微生物所占比率和生物膜扩张随时间的变化关系。
表1计算过程中参数值[2、12]
|
2结果与讨论
2.1L与f随时间的变化
通过基质降解和生物膜生长两过程的计算,可以得出在一定条件下生物膜结构和生物颗粒半径随时间的变化关系。图2给出液相主体溶解氧浓度Cp=0.5mg/L,活性生物膜厚度δ=50μm时,氨氧化菌在生物膜中的比率f和生物颗粒半径L随时间的变化。
从图2可以看出,氨氧化菌在生物膜中的比率随时间的延长逐渐增大,也就是说随着生物膜的扩张氨氧化菌将占据硝化生物膜表面的位置,使氨氧化过程的反应速率增大;由于亚硝酸氧化菌的比率减少,从而使亚硝酸氧化菌逐渐失去在生物膜中的有利位置,亚硝酸的氧化速率减小,出水中的NO2--N浓度逐渐增加,直至完全亚硝酸化,这与大多数的试验观察完全符合。
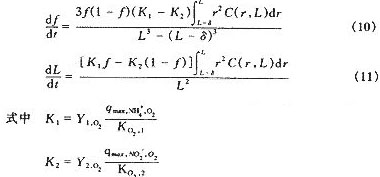 |
2.2Cp对活性生物膜中菌群分布的影响
由式(5)、(10)和(11)可以看出,影响生物膜菌群分布变化的因素有活性生物膜的厚度δ和液相主体的氧浓度Cp。图3为Cp对氨氧化菌在活性生物膜中的比率f的影响。
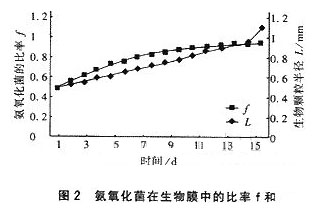 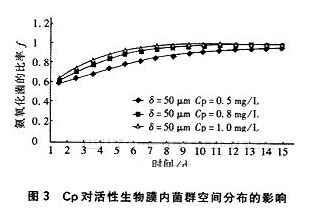 |
从图3可以看出,当活性生物膜的厚度保持不变时,液相主体浓度Cp越大越有利于氨氧化菌的竞争生长,氨氧化菌在较短的时间内就可以达到较高的比率,也就是可以在较短的时间内完成氨氧化菌与亚硝酸氧化菌之间的选择竞争,从而可在较短的时间内实现出水亚硝酸盐的高积累。液相主体的溶解氧浓度越高,通过分子扩散进入生物膜内部特定位置上的溶解氧浓度也就越高,由于氨氧化菌对溶解氧的亲和力比亚硝酸氧化菌对溶解氧的亲和力要强,导致的氨氧化菌生长速率的增加比亚硝酸氧化菌生长速率的增加要大,使竞争过程更为显著。
2.3δ对活性生物膜中菌群分布的影响
当液相主体浓度维持一定时,活性生物膜厚度δ越薄,越容易实现氨氧化菌和亚硝酸氧化菌的选择竞争,氨氧化菌就可以在较短的时间内占据生物膜表面的位置,完成对氨氧化菌的选择。这也可以用氨氧化菌和亚硝酸氧化菌对溶解氧的亲和力不同来解释,在一定的溶解氧浓度条件下,当活性生物膜较薄时,其中的溶解氧平均浓度较大,也就容易实现氨氧化菌的竞争生长。
3结语
通过建立基质扩散—反应及微生物生长的数学模型,从理论上证实了在硝化生物膜中存在着氨氧化菌与亚硝酸氧化菌之间对空间和基质的竞争。这种竞争是由于微生物本身的增殖速率差异造成的。竞争的必然结果是随着时间的延续,氨氧化菌在活性生物膜中的比率逐渐增大,直至占据整个活性层,从而实现持久稳定的亚硝酸化。
参考文献:
[1]GarridoJMetal.Influenceofdissolvedoxygenconcentrationonnitriteaccumulationinabiofilmairliftsuspensionreactor[J].Biotech&Bioeng,1997,53:168-178.
[2]PicioreanuCetal.Modelingtheeffectofoxygenconcentrationonnitriteaccumulationinabiofilmairliftsuspensionreactor[J].WatSciTech,1997,36:147-156.
[3]AblingU,SeyfriedCF.Anaerobic-aerobictreatmentofhighstrengthammoniumwastewaternitrogenremovalusingnitrite[J].WatSciTech,1992,26:1007-1015.
[4]王世和等.生物流化床降解有机物的动力学机理研究[J].东南大学学报,1993,23(1):62-68.[5]FruhenMetal.Significanceofspatialdistributionofmicrobialspeciesinmixedculturebiofilms[J].WatSciTech,1990,23:1365-1374.
[6]ReichertP,WannerO.Movementofsolidsinbiofilms:Significanceofliquidphasetransport[J].WatSciTech,1997,36:321-328.
[7]Wanner,ReichertP.Mathematicalmodelingofmixed-culturebiofilms[J].Biotech&Bioeng,1996,49:172-184.
[8]PaulLBishop.Biofilmstructureandkinetics[J].WatSciTech,1997,36:287-294.
[9]ScharmmAetal.Structureandfunctionofanitrifyingbiofilmasdeterminedbymicroelectrodesandfluorescentoligonucleotideprobes[J].WatSciTech,1997,36:263-270.
[10]LiuYuetal.Specificactivityofnitrifyingbiofilminwaternitrificationprocess[J].WatRes,1996,30:1645-1650.
[11]ShengKunetal.Nitrificationanddenitrificationofhighstrengthammoniumandnitritewastewaterwithbiofilmreactors[J].WatSciTech,1991,23:1417-1425.
[12]Wiesmann.Biologicalnitrogenremovalfromwastewater[A].In:FiechterAdvancesinBiochemicalEngineering/Biotechnologh[C],Berlin:Springer-Verlag,1994,51.

使用微信“扫一扫”功能添加“谷腾环保网”










